- Ecrire la réaction d'oxydoréduction entre le magnésium Mg et les ion oxonuim.
- Tracer le graphe V= f(t).
- A partir de quelle date peut-on considérer que la réaction est terminée ?
- La transformation est-elle lente ou rapide ?
- A partir du graphe déterminer la quantité de matière (mol) de dihydrogène en fin d'expérience sachant que la température est 20°C et la pression 101300 Pa. - Dresser le tableau permettant de suivre l'évolution de la transformation en fonction de l'avancement x.
- Déterminer l'état final du système et comparer avec les résultats expérimentaux. - On recommence la même expérience avec la même longueur de magnésium, mais on verse 10 mL d'acide chlorhydrique de concentration 2 mol/L. On y ajoute 20 mL d'eau. Quelle est l'allure de la courbe ? Justifier.
masse atomique molaire (g/mol) : Mg = 24,3 ; masse linéique du ruban de magnésium : 1 g /m. R= 8,318 S.I.
Solution
le magnésium réducteur s'oxyde : Mg --> Mg2+ + 2e-.
les ions oxonium, l'oxydant se réduisent : 2 H3O+ + 2e- --> H2 + 2H2O.
Mg +2 H3O+ -->Mg2+ + H2 + 2H2O.
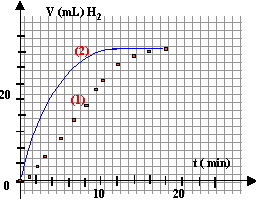
à partir de t = 16 min, le volume de H2 ne change plus : on peut alors considérer la réaction comme terminée.
La réaction est lente, car on peut suivre l'évolution de la réaction ( mesurer le volume de gaz qui se dégage) pendant plusieurs minutes.
à la fin de l'expérience le volume de H2 est V=31,6 mL = 31,6 10-3 L = 31,6 10-6 m3.
Qté de matière de H2 (mol) n =PV / (RT)
avec P= 101300 Pa ; T= 273+20 = 293 K
n = 101300*31,6 10-6 / (8,318*293) =1,313 10-3 mol.
Qté initial des réactifs : nMg = masse (g) / masse molaire = 0,03 / 24,3 = 1,234 10-3 mol
n H+ = concentration (mol/L) * volume (L) = 1*0,01 = 0,01 mol.
1,234-xmax =0 donne xmax = 1,234 mmol ( valeur la plus petite à retenir)
10-2xmax =0 donne xmax = 5 mmol
l'avancement maximum est 1,234 mmol : l'acide est en excès.
la volume théorique de dihydrogène est à peu près égal au volume expérimental : la réaction est terminée à la date t >16 min.
la concentration est un facteur cinétique :
la concentration initiale de l'un des réactifs ( ion oxonium ) double alors la transformation sera plus rapide.
(courbe 2 ci-dessus)






Mon expérience de travail avec Benjamin (un agent de crédit) a été un plaisir. Il était tout à fait franc sur les coûts et sur la question de savoir si l'accord avait un sens financier. En fait, lorsque j'ai expliqué ma situation, il m'a conseillé de ne pas refinancer à moins que les conditions actuelles ne s'améliorent même si cela lui coûte des affaires. Quand il m'a contacté plus tard pour une meilleure offre, j'ai sauté dessus car il avait gagné ma confiance "M'a certainement fait sentir que je travaillais avec une grande société de prêt / un homme d'affaires formidable qui connaissait la valeur de ses secteurs d'activité. toute personne ici à la recherche de tout type de prêt à contacter M. Benjamin car lui et sa société m'ont aidé avec un prêt au taux de 2%, ce qui était très impressionnant.J'ai demandé à M. Benjamin de contacter le courrier électronique du bureau au .... 247officedept@gmail.com
RépondreSupprimer