potassium K2S2O8 (réaction 1). La solution devient jaunâtre par suite de l’apparition progressive d’iode.
On se propose d’étudier la vitesse de formation du diiode en fonction du temps. Pour cela, on opère des prélèvements de 10 cm3 du milieu réactionnel aux différents temps t. La réaction de formation du diiode
dans les prélèvements est arrêtée par dilution dans de l’eau distillée glacée. On dose alors l’iode présent dans les prélèvements au moyen d’une solution titrée de thiosulfate de sodium Na2S2O3 de concentration
molaire 0,01 mol.L-1, cette réaction de dosage étant supposée instantanée (réaction 2).
Données : E° ( S2O82- / SO42- ) =2,01 V ; E° ( S4O62- / S2O32- ) =0,08 V ; E° ( I2 / I- ) =0,62 V.
Ecrire les équations-bilan des réactions 1 et 2.S2O82- +2e-= 2SO42- ; 2I- = I2 +2e- .
S2O82- +2I- = 2SO42- + I2 (1).
2S2O32- =S4O62- +2e- ; I2 +2e- = 2I- ; 2S2O32- + I2 = S4O62- + 2I- (2).
On mesure le volume V de solution de thiosulfate de sodium versé dans chacun des prélèvements du milieu réactionnel.
Etablir la relation liant la concentration molaire du diiode formé en fonction du volume V (en cm3).
n(I2) =½ n(S2O32-) = 0,5 C V = 0,5*0,01 V= 5 10-3 V ( mmol)
Compléter la 3è ligne du tableau suivant.[I2] = 5 10-3 V / volume prélevement = 5 10-3 V / 10 = 5 10-4 V mol/L
Tracer la courbe [I2]= f(t). Echelle : 1 cm pour 5 min et 1 cm pour 5.10-4 mol.L-1.
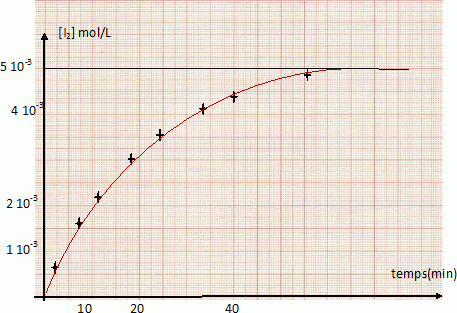
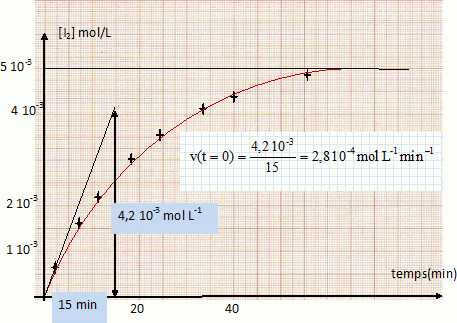
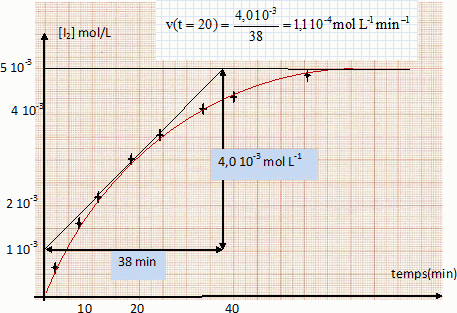
Déterminer graphiquement la vitesse instantanée de formation du diiode à volume constant, aux temps t1 = 0 min et t2 = 20 min. Comment varie-t-elle au cours du temps ? Pourquoi ?
Déterminer le coefficient directeur de la tangente à la courbe au point considéré.
D’après l’allure de la courbe, quelle sera la concentration molaire du diiode obtenu au bout d’un temps infini ?
[I2] infini =5 10-3 mol/L.
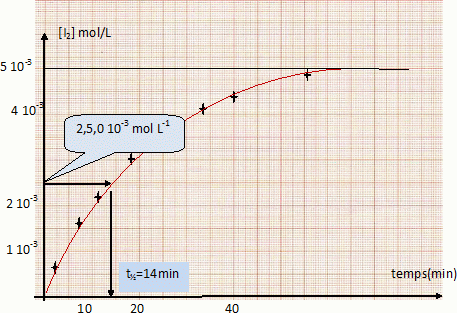
Définir le temps de demi-réaction et déterminer graphiquement sa valeur.
Le temps de demi-réaction t½ est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final xf.
le volume étant constant : [I2] t½ =0,5 [I2] infini =2,5 10-3 mol/L.





0 commentaires:
Enregistrer un commentaire