Le zinc réagit avec l'acide chlorhydrique : les produits de la réaction sont les ions Zn2+ et du dihydrogène.
- Ecrire l'équation chimique de la réaction.
- Quel couples oxydant / réducteur fait elle intervenir ? - On plonge un petit morceau de zinc dans l'acide chlorhydrique et on étudie la cinétique de la réaction en mesurant, à l'aide d'une éprouvette graduée, le volume de dihydrogène produit au cours du temps, on obtient les résultats suivants :
- Justifier que la technique de mesure utilisée est bien adaptée au suivi cinétique de la réaction.t (min) 0 1 2 3 4 5 V H2(mL) 0 6,3 9,9 12 13,5 14,5
- Tracer le graphe représentant la quantité de matière de dihydrogène formée en fonction du temps, sachant que le volume molaire dans les conditions de l'expérience est de 24 L/mol.
- Si on faisait la même expérience avec l'acide moins concentré, faudrait il plus ou moins de deux minutes pour recueillir 9,9 mL de dihydrogène ?
- Le volume de gaz produit au bout d'un temps très long sera-t-il le même pour les deux expériences. - On utilise deux systèmes initiaux de compositions identiques, à la même température, avec dans un cas du zinc en poudre et dans l'autre cas du zinc en grenaille.
- On observe que le dégagement gazeux est plus important dans le système où le zinc est à l'état de poudre. Sachant que la réaction a lieu à la surface du métal, proposer une interprétation.
- Le volume gazeux obtenu à l'état final est il le même dans les deux cas ? Pourquoi ?
Solution
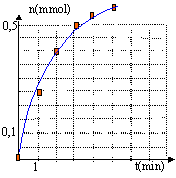
la concentration des réactifs est un facteur cinétique : la vitesse de la réaction augmente avec leur concentration.
si l'acide est moins concentré il faudra plus de deux minutes pour recueillir 9,9 mL de gaz.
Si le zinc est le réactif limitant, alors le volume de gaz obtenu sera le même
si l'acide moins concentré est le réactif limitant, le volume de gaz sera plus faible.
la réaction chimique se fait à la surface du métal : plus celle-ci est grande ( solide en poudre) , plus la vitesse de la réaction est importante. L'état final sera plus rapidement atteint.
Par contre l'état final sera identique, si les quantités initiales de réactifs sont les mêmes.





Borgata Hotel Casino & Spa in Atlantic City, NJ Jobs
RépondreSupprimerBorgata Hotel 공주 출장안마 Casino & Spa has 3 양주 출장마사지 locations 수원 출장마사지 in Atlantic City, New 구미 출장샵 Jersey and Pennsylvania, including Hollywood Casino at Oceanfront Beach, 나주 출장샵